研究内容
当研究室では、生物活性分子そのものの合成研究だけでなく、有機化学・生物学の知見を利活用して新しい生物活性分子を創り出す研究に挑戦しています。様々な化合物を研究対象にしますが、特に天然物、糖、脂質を元にして、これまでよりも活性の高い化合物、新しい機能を付与した化合物などを設計し、それを自らの手で合成し、機能評価する研究に取り組んでいます。以下に、これまでの主な成果をまとめます。
1. 天然有機化合物を基盤とする生物活性分子創製研究
植物の酸化ステロイド類に関する生物有機化学的研究
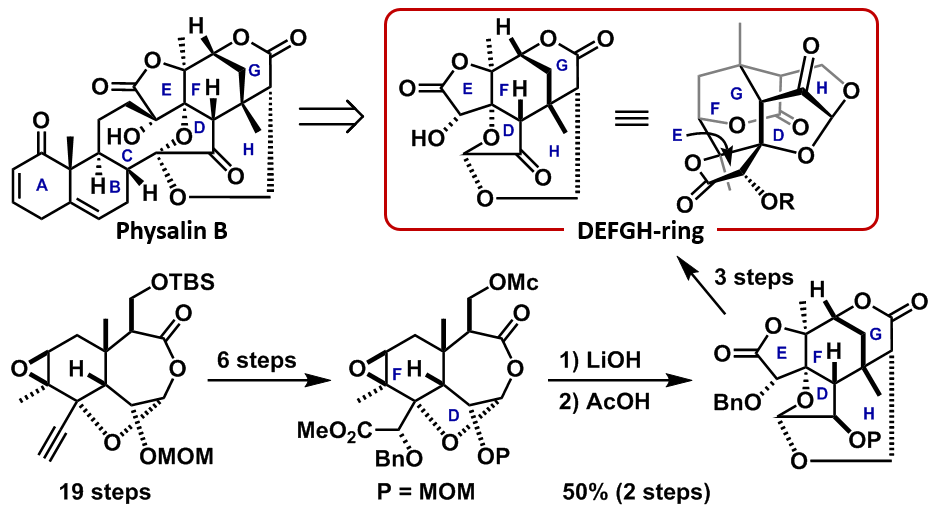
Physalin類は、ホオズキの葉から単離されたステロイド化合物であり、近年、古典的NF-κB経路の転写活性化阻害作用等、様々な生物活性が報告されています。私達は、特徴的な右側構造(DEFGH環部)の生物活性に興味を持ち、この複雑な骨格の合成とその生物活性評価に取り組みました。
25工程で調整した3環性の前駆体を塩基と酸で順次処理すると、ワンポットで環骨格の組み換えが進行し、目的のDEFGH環骨格を構築することができました。3工程でPhysalin類のDEFGH環部構造の合成に成功しました。
Physalin類と類似の酸化ステロイド天然物を用いて、NF-κB転写活性化阻害作用を指標として、構造–作用機序相関を調べました。その結果、5,6-Epoxy型の天然物は、NF-κBの阻害因子であるIκBαのリン酸化と分解を抑制していることが分かりました。一方、Physalin Bは、NF-κBの核内移行やDNAへの結合を阻害していました。さらに、合成したDEFGH環部も阻害活性を示し、Physalin Bと同様の作用機序を示しました。このことから、Physalin類の右側構造は、その作用機序に大きく寄与していることを見出しました。
[ACS Med. Chem. Lett. 2013, 4, 730.] 。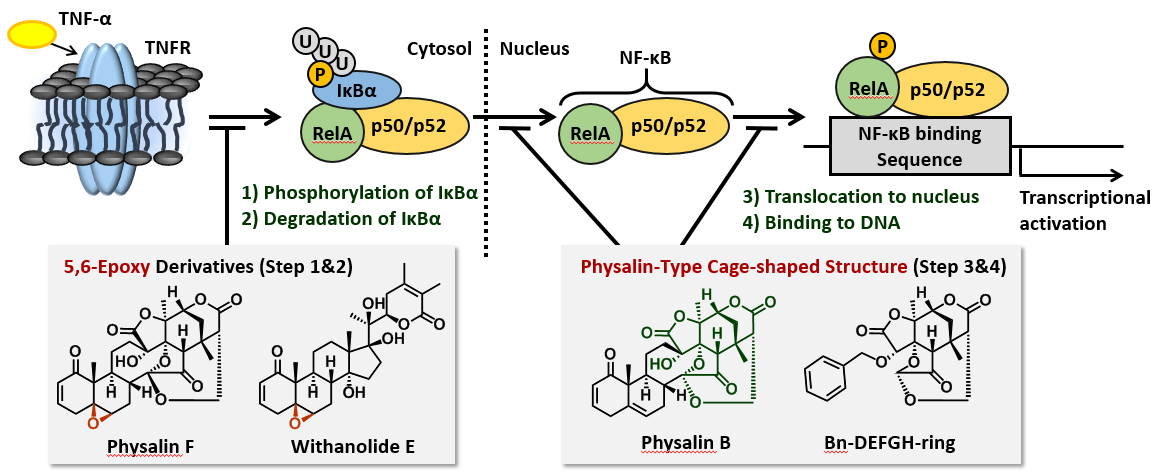
2. 糖・糖脂質・脂質を基盤とする新規機能性分子創製研究
代謝安定型糖脂質ガングリオシドアナログ
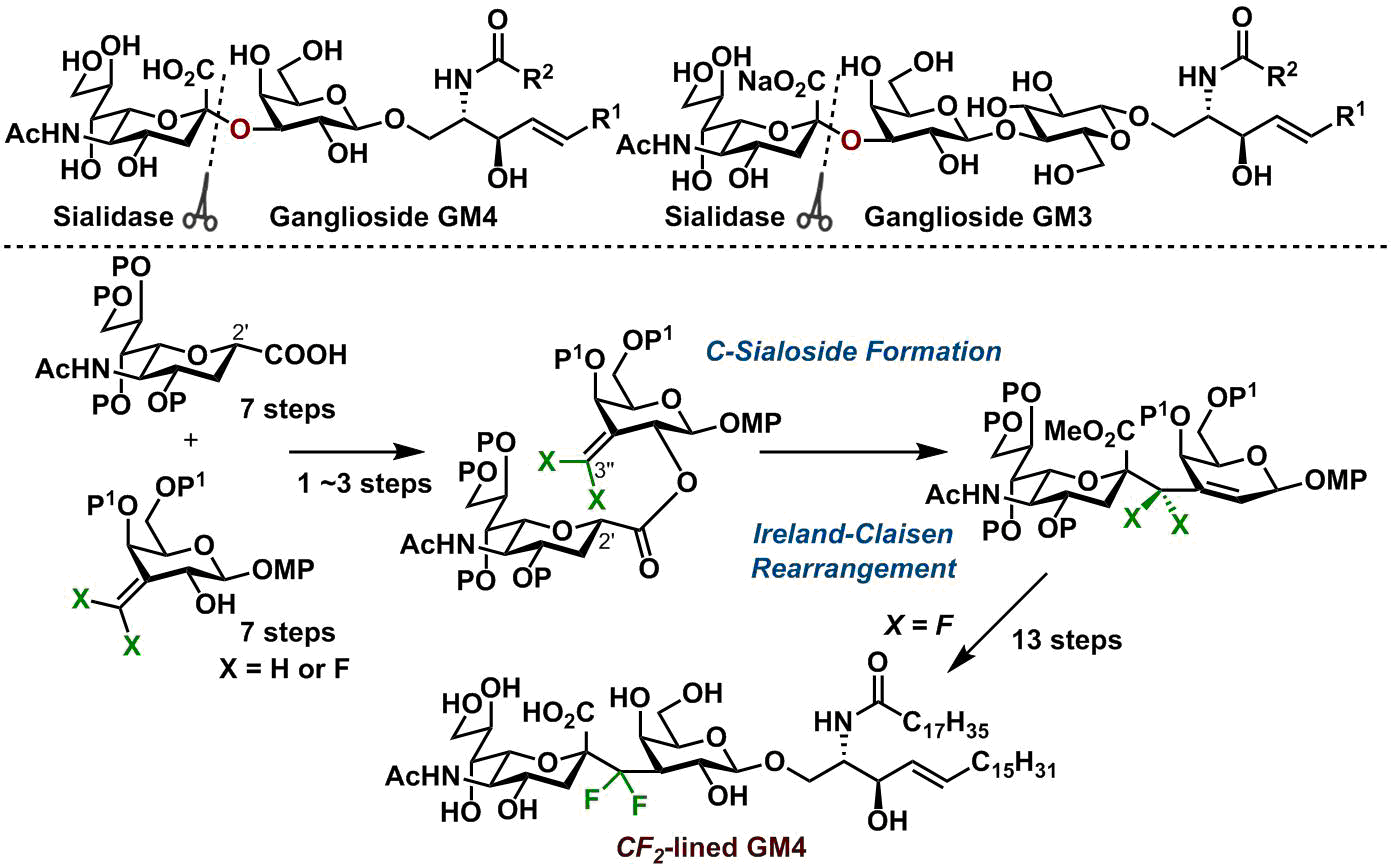
ガングリオシドは、スフィンゴ糖脂質の1種であり、細胞増殖・分化などに関わっていることが知られています。しかしその機能は依然謎が多く、nativeのガングリオシドだけでは詳細な機能解明に至っていないのが現状です。その原因の1つとして、生体内でのガングリオシドの代謝分解が考えられました。そこで私達は、代謝耐性を有し、且つnativeガングリオシドの性質を再現するアナログ分子の開発に取り組んでいます。代謝分解の起点は、シアリダーゼによるシアル酸とガラクトースのグリコシド結合の切断です。私達はそのO原子(O-シアロシド結合)をC原子に置き換え(C-シアロシド結合)、さらにO原子の性質を模倣するようF原子を導入したCF2-連結型ガングリオシドアナログを設計しました。Ireland-Claisen転位反応を利用したC-シアロシド合成法を独自に開発して、最も簡単な構造のガングリオシドであるGM4のCF2-連結型アナログの合成を達成しました。本合成は、C-グリコシド結合を含むガングリオシドの世界初の合成例で、現在においても唯一の研究例になります。この化合物は、代謝耐性をもつこと、さらにGM4の機能を持つことを確認しています。
本C-シアロシド結合構築法は、CH2-シアロシド結合構築にも利用できることから、様々なC-シアロシド結合の構築が可能と期待できます。
[(a) J. Am. Chem. Soc. 2007, 129, 15420. (b) Org. Lett. 208, 10, 4167.]その他、糖脂質関連研究の論文[(a) Chem. Lett. 2011, 40, 877. (b) Chem. Lett. 2013, 44, 1389-1391.(c) Tetrahedron Lett. 2017, 58, 2915.]
3.Focused Library:天然物を基にした“コア構造”の設計と目的志向型ライブラリー構築
目的志向型ライブラリー(Focused library、FL)は、活性発現に必須の“コア構造”を共通に持つ化合物群であり、ある標的選択的に作用する化合物の探索に有用と考えられます。ここでコア構造の選択が重要ですが、私達は天然物の欠点や作用機序に着目して新規コア構造を設計するというアプローチで、これまでに2種のライブラリーを構築しました。
A:プロテインキナーゼC(PKC)の活性制御分子
タンパク質リン酸化酵素の1種であるPKCの一部は、細胞内で生じるセカンドメッセンジャーであるジアシルグリセロール(DAG)によって活性化されます。私達は、DAGのフレキシブルなコンホメーションを固定できる安定性の高いコア構造を設計し、これを基に目的志向型ライブラリーを構築しました(IB誘導体、工程数10~17、総60化合物)。本ライブラリーの中から、PKCαの活性化剤、PKCαに結合するが全く活性化しない化合物、PKCαの阻害剤(投稿準備中)など、ユニークな活性制御分子を見出すことに成功しました。
[(a) Bioorg. Med. Chem. Lett. 2004, 14, 2963. (b) Bioorg. Med. Chem. Lett. 2004, 14, 2969. (c) Tetrahedron Lett. 2009, 50, 3609. (d) Bioorg. Med. Chem. Lett. 2011, 21, 3587.]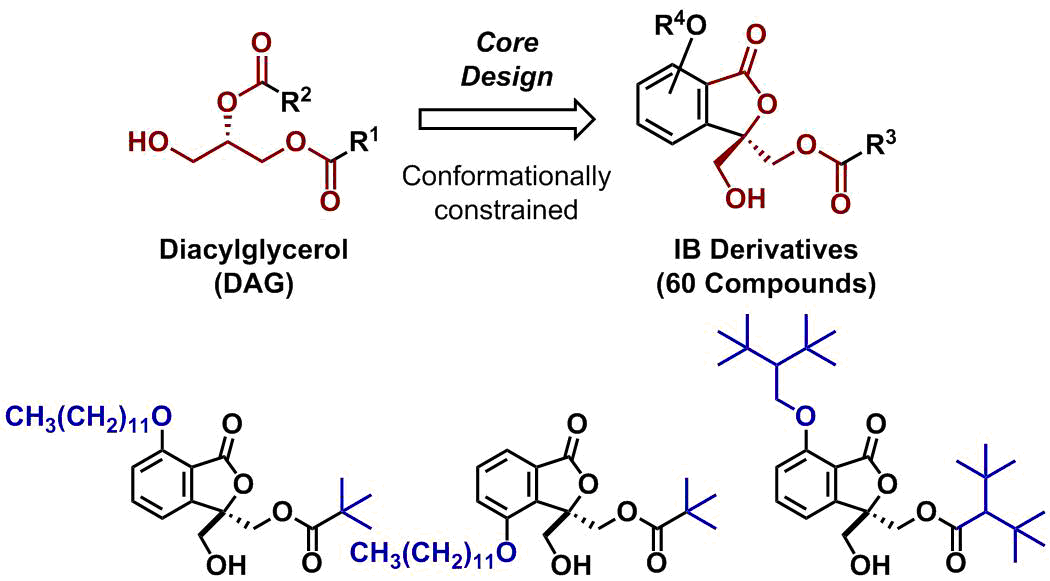
B:両特異性プロテインホスファターゼ(DSP)類の阻害剤
リン酸化タンパク質のリン酸基を除去するプロテインホスファターゼは、PP類(25種)とPTP類(107種)に分類されます。PTP類にはDSP類(同じタンパク質上のセリン-スレオニンおよびチロシンに結合したリン酸基を除去できる)も含まれ、これらは構造的に似通っています。このことから、PTP/DSP類に対する酵素選択的な阻害剤創製は困難とされています。私達は、ホスファターゼ活性を阻害する天然物RK-682を基に、細胞膜透過性・酵素選択性の改善を目指して、新規コア構造を設計し、これを基に目的志向型ライブラリーを構築しました(RE誘導体、工程数約6工程、総160化合物)。その中からVHR選択的なRE12、CDC25Bに選択性の高いRE44、HeLa細胞の増殖抑制効果を示すVHR阻害剤RE176の開発に成功しました。RE12とRE44は和光純薬工業から市販されています。
[(a) ChemMedChem 2011, 6, 612. (b) ACS Med. Chem. Lett. 2012, 3, 294. (c) Bioorg. Med. Chem. 2014, 22, 2771.]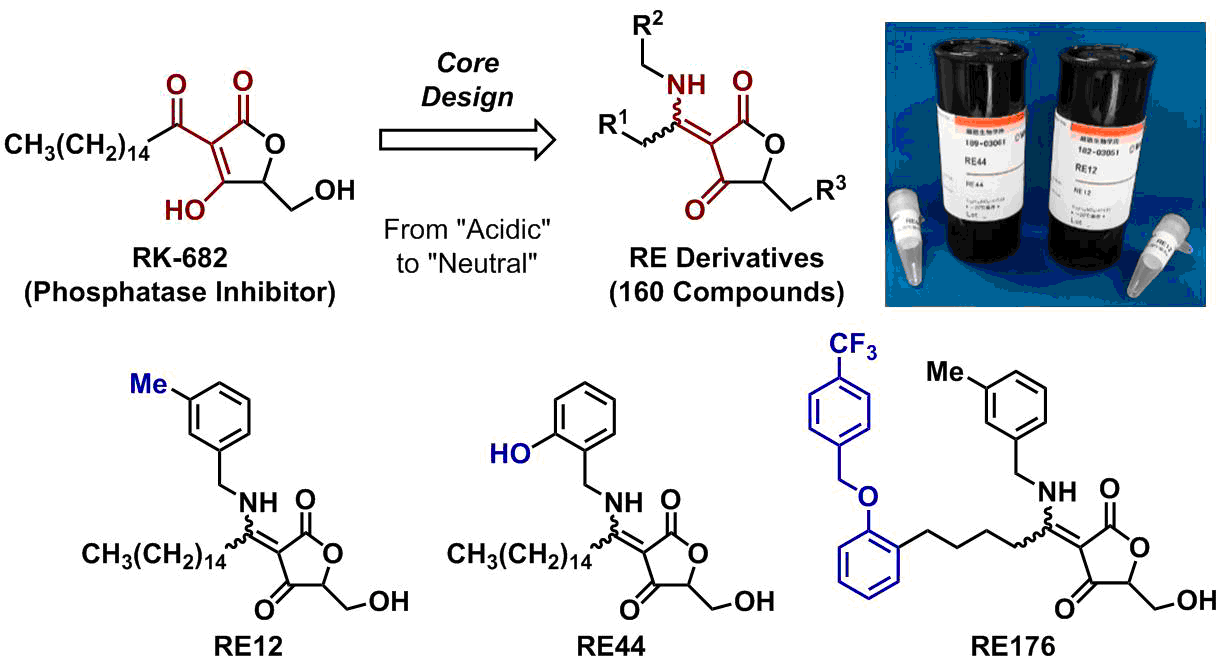
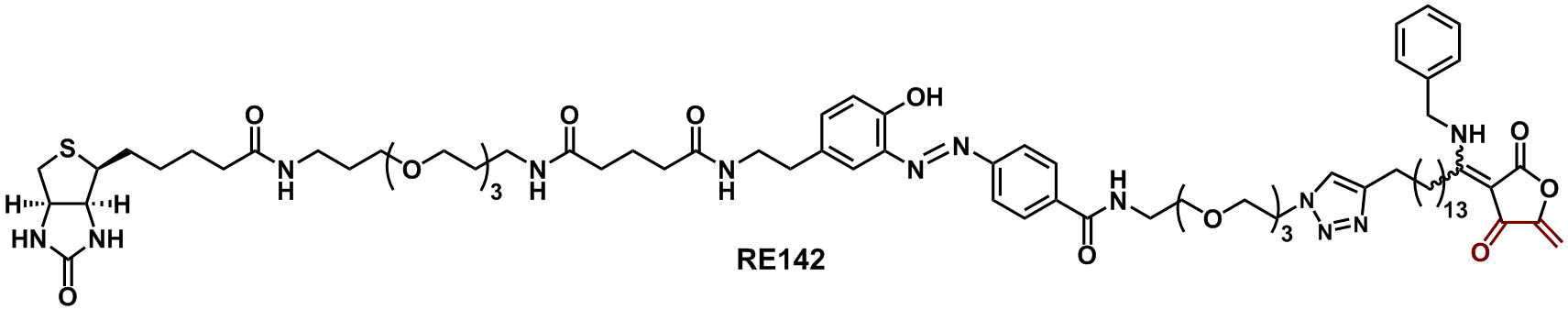
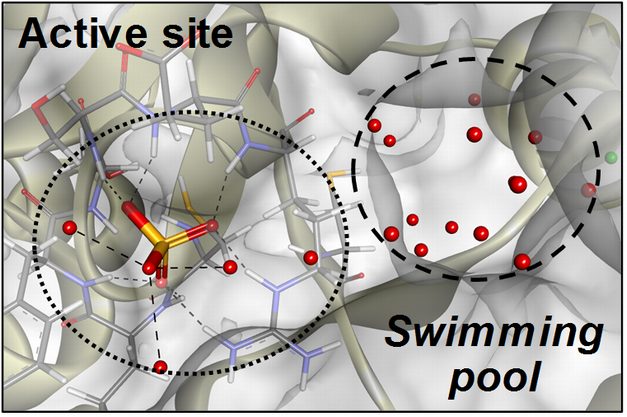
RE誘導体は、基質に対して非拮抗型でCDC25AおよびCDC25Bを阻害します。私達は、CDC25類と共有結合を形成できるRE誘導体、さらに結合サイト同定用プローブRE142を開発しました。これによって、RE誘導体はCDC25活性中心の隣に存在する深いポケット(Swimming Pool)に結合していることを見出し、ユニークな阻害選択性の発現メカニズムの一部を明らかにすることに成功しました。
[(a) Mol. BioSyst. 2013, 9, 1026. (b) Acc. Chem. Res. 2015, 48, 1464.]